Mon panier
Sous-total du panier
Aucun article dans votre panier.
Créer un compte a de nombreux avantages :
Veuillez nous contacter par téléphone ou par e-mail et nous examinerons ensemble les possibilités.
Nos méthodes de livraison :
Collecte à la pharmacie
Ceci est un médicament, pas d'utilisation au long cours sans avis médical, tenir hors de portée des enfants, lire attentivement la notice. Consultez votre médecin ou votre pharmacien. En cas d'effets secondaires, contactez votre médecin.
Les médicaments ne sont pas des produits comme les autres. Ils ne peuvent jamais être repris ni échangés. La loi interdit formellement aux pharmaciens de reprendre des médicaments non utilisés. Pour votre sécurité, tous les médicaments que vous rapportez à la pharmacie sont intégrés dans le circuit de collecte des médicaments périmés.
En tant que pharmaciens, nous offrons également des soins pharmaceutiques. Après l'achat d'un médicament ou d'un dispositif médical, vous pouvez également nous contacter si vous avez des questions. N'hésitez pas à nous contacter par co
En savoir plus sur Indication , Composition , Effets secondaires , Contre indication , Utilisation , Détails et Notice .
AMGEVITA en association au méthotrexate est indiqué pour :
• le traitement de la polyarthrite rhumatoïde modérément à sévèrement active de l'adulte lorsque la
réponse aux traitements de fond (DMARD), y compris le méthotrexate, est inadéquate.
• le traitement de la polyarthrite rhumatoïde sévère, active et évolutive chez les adultes non
précédemment traités par le méthotrexate.
AMGEVITA peut être donné en monothérapie en cas d'intolérance au méthotrexate ou lorsque la
poursuite du traitement avec le méthotrexate est inadaptée.
AMGEVITA ralentit la progression des dommages structuraux articulaires mesurés par radiographie et
améliore les capacités fonctionnelles lorsqu'il est administré en association au méthotrexate.
Une seringue unidose préremplie contient 40 mg d'adalimumab dans 0,8 mL de solution (50 mg/mL).
4.8 Effets indésirables
Résumé du profil de tolérance
L'adalimumab a été étudié chez 9 506 patients dans des essais pivots contrôlés et en ouvert d'une durée de 60 mois et plus. Ces essais ont inclus des patients atteints de polyarthrite rhumatoïde récente ou ancienne, d'arthrite juvénile idiopathique (arthrite juvénile idiopathique polyarticulaire et arthrite liée à l'enthésite) ou des patients souffrant de spondyloarthrite axiale (spondylarthrite ankylosante et spondyloarthrite axiale sans signes radiographiques de SA), de rhumatisme psoriasique, de la maladie de Crohn, de rectocolite hémorragique, de psoriasis et d'hidrosadénite suppurée et d'uvéite. Les études contrôlées pivots portaient sur 6 089 patients ayant reçu de l'adalimumab et 3 801 patients ayant reçu un placebo ou un comparateur actif pendant la phase contrôlée.
Le pourcentage de patients ayant interrompu le traitement en raison d'effets indésirables pendant la phase en double aveugle, contrôlée, des études pivots a été de 5,9 % chez les patients traités par l'adalimumab et de 5,4 % chez les patients du groupe contrôle.
Les effets indésirables les plus fréquemment rapportés sont les infections (telles que les rhinopharyngites, les infections des voies respiratoires hautes et les sinusites), les réactions au site d'injection (érythème, démangeaisons, hémorragie, douleur ou gonflement), les céphalées et les douleurs musculo-squelettiques.
Des effets indésirables graves ont été rapportés avec l'adalimumab. Les antagonistes du TNF, tels qu'AMGEVITA affectent le système immunitaire et leur utilisation peut avoir des répercussions sur les défenses du corps contre les infections et le cancer.
Des infections menaçant le pronostic vital et d'issue fatale (comprenant sepsis, infections opportunistes et tuberculose), des réactivations d'hépatite B et différents cancers (y compris leucémie, lymphome et lymphome hépatosplénique à lymphocytes T) ont également été rapportés avec l'utilisation de l'adalimumab.
Des effets hématologiques, neurologiques et autoimmuns sévères ont été aussi rapportés. Ceci comprend de rares cas de pancytopénie, d'anémie médullaire, des cas de démyélinisation centrale et périphérique et des cas de lupus, d'événements liés au lupus et de syndrome de Stevens-Johnson.
Population pédiatrique
En général, la fréquence et le type des événements indésirables observés chez l'enfant et l'adolescent ont été comparables à ceux observés chez les patients adultes.
Hypersensibilité au principe actif ou à l'un des excipients mentionnés à la rubrique 6.1.
Tuberculose évolutive ou autres infections sévères telles que sepsis et infections opportunistes (voir
rubrique 4.4).
Insuffisance cardiaque modérée à sévère (NYHA classes III/IV) (voir rubrique 4.4).
Chez les patients adultes atteints de polyarthrite rhumatoïde, la posologie recommandée d'AMGEVITA
est une dose unique de 40 mg d'adalimumab administrée toutes les deux semaines, par voie
sous-cutanée. L'administration de méthotrexate doit être continuée pendant le traitement par
AMGEVITA.
Les glucocorticoïdes, les salicylés, les anti-inflammatoires non stéroïdiens ou les antalgiques peuvent
être poursuivis pendant le traitement par AMGEVITA. En ce qui concerne l'association aux autres
médicaments anti-rhumatismaux de fond autres que le méthotrexate (voir rubriques 4.4 et 5.1).
En monothérapie, certains patients chez qui l'on observe une diminution de leur réponse à AMGEVITA
40 mg toutes les deux semaines, peuvent bénéficier d'une augmentation de la posologie à 40 mg
d'adalimumab toutes les semaines ou 80 mg toutes les deux semaines.
Les données disponibles de l'adalimumab laissent supposer que la réponse clinique est habituellement
obtenue en 12 semaines de traitement. La poursuite du traitement devra être reconsidérée chez un patient
n'ayant pas répondu dans ces délais.
| CNK | 4828497 |
|---|---|
| Organisations | Amgen nv |
| Marques | Amgen |
| Largeur | 129 mm |
| Longueur | 175 mm |
| Profondeur | 91 mm |
| Forme galénique | Vaporisateur |
| Ingrédients actifs | adalimumab |
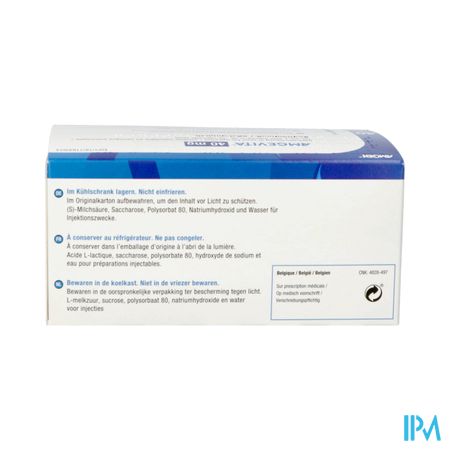
| Conservation | Frais (8°C - 15°C) |